Cover Story Immunity: Wenn Fresszellen Dampf ablassen
Highlights
- IL-33 induziert eine schnelle mitochondriale Neuverdrahtung in Makrophagen
- Entkopplung der Atmungskette fördert IL-33-induzierte AAM-Differenzierung
- GATA3 verbindet Makrophagen-Stoffwechsel und Differenzierung als Reaktion auf IL-33
- GATA3 steuert die Differenzierung von pro-resolvierenden Makrophagen in vivo
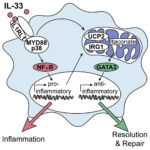
Alternativ aktivierte Makrophagen (AAMs) tragen zur Behebung von Entzündungen und zur Gewebereparatur bei. Die molekularen Wege, die ihre Differenzierung steuern, sind jedoch noch nicht vollständig geklärt. Hier zeigen wir, dass die durch das Entkopplungsprotein-2 vermittelte mitochondriale Umprogrammierung und der Transkriptionsfaktor GATA3 spezifisch die Differenzierung von pro-resolvierenden AAMs als Reaktion auf das Alarmin IL-33 steuern. In Makrophagen löste IL-33 nacheinander die frühe Expression von pro-inflammatorischen Genen und die anschließende Differenzierung in AAMs aus. Eine globale Analyse der zugrundeliegenden Signalereignisse ergab, dass IL-33 eine schnelle metabolische Umstellung der Makrophagen auslöste, die mit einer Entkopplung der Atmungskette und einer erhöhten Produktion des Metaboliten Itaconat einherging, was anschließend eine GATA3-vermittelte AAM-Polarisierung auslöste. Die konditionale Deletion von GATA3 in mononukleären Phagozyten hob dementsprechend die IL-33-induzierte Differenzierung von AAMs und die Gewebereparatur bei Muskelverletzungen auf. Unsere Daten weisen somit auf einen IL-4-unabhängigen und GATA3-abhängigen Weg in mononukleären Phagozyten hin, der aus einer mitochondrialen Neuverdrahtung resultiert und die Makrophagenplastizität und das Abklingen der Entzündung steuert.
Weitere Informationen:
Prof. Dr. Gerhard Krönke
Telefon: 09131 85-34742
E-Mail: gerhard.kroenke(at)uk-erlangen.de

